Dikerogammarus haemobaphes Eichwald, 1841
 Photo © Alex Borisenko, Centre for Biodiversity Genomics. v.3 BOLD Systems. CC BY-NC-SA (2017)
Photo © Alex Borisenko, Centre for Biodiversity Genomics. v.3 BOLD Systems. CC BY-NC-SA (2017)
Семейство Gammaridae.
Понто-каспийский вид, проникший на территорию Беларуси по р. Днепр. Самый распространенный чужеродный вид в Беларуси. Он распространился по р. Днепр до д. Буйничи (Могилевский р-н), по Березине до г. Бобруйска, по Сожу до Чечерска, по Припяти до г. Пинска, по Пине до д. Дубой (Пинский р-н), по Горыни до д. Белоуша (Столинский р-н) и по Мухавцу до г. Бреста. Наиболее распространёнными видами в бассейне Днепра являются Dikerogammarus vilosus и D. haemobaphes, которые встречаются на всех исследованных створах. Максимальная численность этих видов по сравнению с другими амфиподами отмечена в речных портах. Сравнительный анализ сообщества амфипод показывает, что D. haemobaphes доминирует как в Днепре, так и в Припяти и является наиболее успешным инвайдером. На различных створах исследованных рек удельная роль понто-каспийских амфипод в общей численности макрозообентоса может достигать 15-20%.
Строительство ряда водохранилищ на р. Днепр в ХХ столетии и судоходство привели к быстрой экспансии этих видов в бассейн р. Днепр. Так после строительства Днепропетровского водохранилища два вида амфипод Pontogammarus robustoides и D. haemobaphes образовали устойчивые популяции и стали доминантными видами, хотя ранее они встречались очень редко на этом участке Днепра.
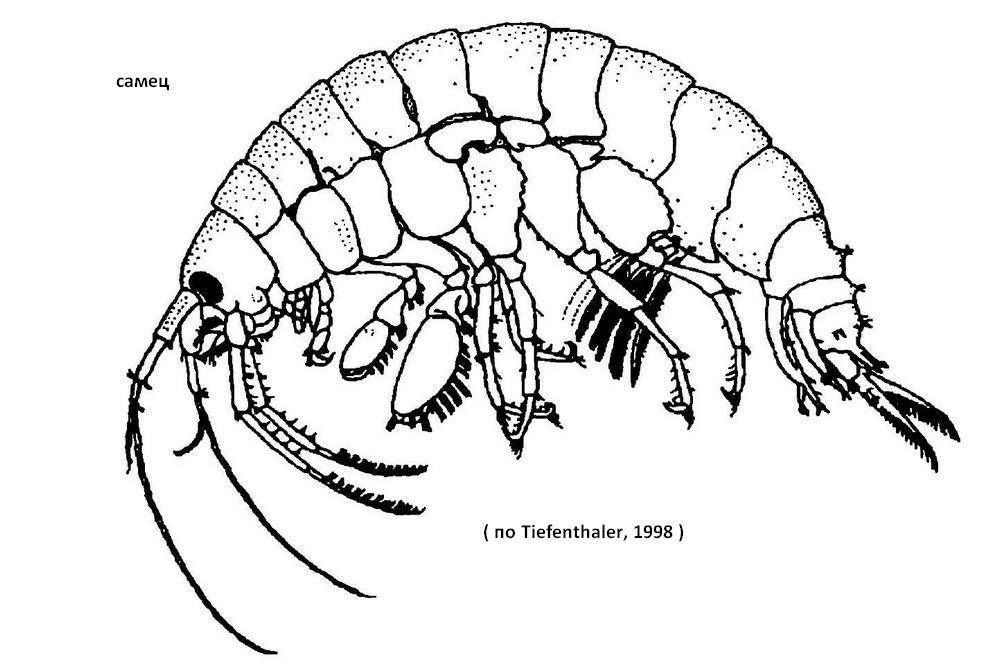
Бугорки на сегментах уросомы конические, несут по два шипа. Антенны I и II приблизительно одной длины, добавочный жгутик хорошо развит. Жгут антенн I у самца имеет не более 30 члеников, добавочный жгутик 7-9-членистый. У антенн II стебель с несколькими пучками волосков. Гнатоподы II крупнее I, у самцов крупнее, чем у самок. Переоподы довольно мощные, расширенные; базальный членик V пары с лопастью на нижнезаднем углу, иногда с прямым задним краем. Уроподы III с длинным экзоподитом, не менее чем вдвое превосходящим стебель и несущим по обоим краям оперенные волоски и группы шипиков; эндоподит маленький, чешуевидный. Длина до 15-16 мм. Однако отловленные в Беларуси особи имеют несколько более крупные размеры. Длина самцов и самок, соответственно, в р. Припять 3,6-18,6 мм (10,6±0,3) и 3,6-19,3 мм (9,9±0,18); в р. Днепр 4,5-18,9 мм (11,5±0,4) и 4,9-18,6 мм (10,3±0,3); в р. Сож 4,0-20,4 мм (10,6±0,5) и 4,6-19,5 мм (10,0±0,4); в р. Мухавец 3,9-16,4 мм (10,1±0,4) и 4,2-15,3 мм (9,3±0,2); в р. Пина 9,5-21,2 мм (12,2±0,9) и 4,2-13,1 мм (9,2±0,6); в р. Горынь 5,7-15,5 мм (9,8±1,5) и 5,3-15,4 мм (9,7±1,0); в Днепро-Бугском канале 5,4-16,6 мм (10,8±1,2) и 6,9-12,2 мм (9,9±0,6).
Достоверных корреляционных связей между числом видов и численностью амфипод, с одной стороны, и гидрохимическими показателями, с другой, в 2011 г. не было выявлено. В то же время наблюдаются различия в числе видов и структуре сообщества амфипод, которые, видимо, вызваны различным уровнем воды в реках и, соответственно, разной шириной зоны и уровня развития водной растительности в прибрежной части рек. Так в 2007 г. на отдельных створах вода выходила на пойму р. Припять, что не наблюдалось в 2011 г. Известно, что понто-каспийские амфиподы в своём большинстве предпочитают биотопы с погружённой водной растительностью и классифицируются как фитофильные виды.
Несмотря на доминирующее положение в обеих реках, удельная роль D. haemobaphes в общей численности амфипод в р. Днепр была ниже по сравнению с таковой в р. Припять. D. haemobaphes является одним из наиболее успешных понто-каспийских видов амфипод по освоению новых местообитаний. Он также доминирует в верхней части р. Днепр. В реках Припять и Днепр его удельная роль в общей численности амфипод имеет тенденцию к увеличению по направлению к верхнему течению реки. Основываясь на анализе жизненного цикла различных понто-каспийских амфипод, D. haemobaphes и P. robustoides являются наиболее успешными видами. В то же время P. robustoides вытесняет D. haemobaphes в условиях отсутствия течения, но при наличии течения D. haemobaphes восстанавливает своё доминирование. На различных створах исследованных рек удельная роль понто-каспийских видов может достигать 15-20% в основном за счёт массового развития D. haemobaphes.
При начале отбора проб в весенне-летнее время (27.03.15) на выбранном створе реки Сож в н. п. Ченки (Гомельский р-н) была низкая температура (6,4°С) и наблюдался максимальный уровень воды во время слабо выраженного весеннего половодья. В этот период видовой состав амфипод был неполным - в пробах присутствовали только три вида, среди которых и D. haemobaphes. Яйценосные самки и ювенильные особи не выявлены, вероятнее всего, в связи с низким температурным показателем воды и неспособностью ракообразных приступить к размножению в данных условиях среды. С постепенным понижением уровня и повышением температуры воды в прибрежной зоне (12.04.15) до 7,3°С наблюдалась тенденция к увеличению численности. Появляются ювенильные особи, что могло бы свидетельствовать о начале периода размножения для этих видов разноногих ракообразных. Но при этом наблюдалось полное отсутствие в пробах макрозообентоса яйценосных самок. Вероятнее всего, это животные предыдущей генерации, которые пережили зиму в водоеме. Появление их в прибрежье молоди, очевидно, связано с постепенным перемещением этих особей из менее прогретых и более глубоких участков водоема на прибрежную отмель, где вода хорошо прогревается и имеется множество укрытий (камни, коряги, комья торфа и почвы, раковины моллюсков и т. п.), что ускоряет их развитие и служит убежищем от выедания хищниками, которые редко приближаются к урезу воды.
 Photo © Alex Borisenko, Centre for Biodiversity Genomics. v.3 BOLD Systems. CC BY-NC-SA (2017)
Photo © Alex Borisenko, Centre for Biodiversity Genomics. v.3 BOLD Systems. CC BY-NC-SA (2017)
Начало размножения отмечено 26.04.15 для всех видов амфипод, присутствующих в пробе, при достижении температуры водной среды 11,9°С. Отмечались единично и ювенильные особи, что, вероятно, может быть связано с дальнейшим развитием молоди предыдущих генераций. Таким образом, начало размножения совпало с нижней границей температурного оптимума (12°С), который указывается в литературе для особей из исходного ареала.
На фоне дальнейшего повышения температуры 10.05.15 наблюдался уже полный для этого створа видовой состав. Отмечено понижение насыщения воды кислородом, которое достигло минимального значения 6,4 мг/л. Известно, что величина нижней границы жизнедеятельности по концентрации кислорода для амфипод составляет 1,5 мг/л. Такое снижение концентрации не привело к негативным изменениям в популяциях чужеродных видов.
Как показали полученные данные, уже сформированный видовой состав разноногих ракообразных сохраняется и при последующих наблюдениях на данном створе 27.05.15. Доля ювенильных особей постепенно возрастает. Доля яйценосных самок на этом отрезке времени росла до середины мая, затем у некоторых видов стабилизировалась, а к концу мая начала снижаться. По имеющимся данным, можно констатировать наличие первого весеннего пика размножения, который припадает на конец первой декады мая.
Известно, что D. haemobaphes обладает самой большой потенциальной плодовитостью, с репродуктивным периодом, состоящим из трех поколений: осенних или перезимовавших, весенних и летних особей. Минимальные размер, при которых возможно определить половую принадлежность равен 3,6 мм при массе 1,8 мг. Диапазон длины тела, выловленных нами половозрелых яйценосных самок от 4,2 до 21,9 мм с массой 2,7 мг и 148,0 мг, соответственно. Для центральной Европы указываются следующие параметры размножения вида: средний размер яйценосной самки 10,99 мм, среднее количество яиц в кладке 42,84, средний период размножения 5,5 месяцев, количество генераций в год - 3.
При среднем размере самок 13,1±0,1 мм с массой 27,9±0,9 мг, количество яиц в выводковой камере 27, тогда как по литературным данным может достигать от 23 до 171 яиц. Наименьший диаметр яйца составляет 0,27 мм, наибольший - 0,94 мм, при средней величине 0,52±0,02 мм. В литературе приводится немного меньшая величина - 0,43 мм, но для яиц только II стадии. Основу полигона распределения яйценосных самок составляют особи с размерами 8-14 мм с пиком на 10-12 мм.
 Photo © Alex Borisenko, Centre for Biodiversity Genomics. v.3 BOLD Systems. CC BY-NC-SA (2017)
Photo © Alex Borisenko, Centre for Biodiversity Genomics. v.3 BOLD Systems. CC BY-NC-SA (2017)
Литература
1. Макаренко А. И. "Плодовитость чужеродных видов амфипод из водоемов Беларуси" / Актуальные проблемы зоологической науки в Беларуси: Сборник статей XI Зоологической Международной научно-практической конференции, приуроченной к десятилетию основания ГНПО «НПЦ НАН Беларуси по биоресурсам». Минск, 2017. С.271-279
2. Макаренко А. И. "Развитие чужеродных амфипод (Crustacea, Gammaridae) в весенний период в реке Сож" / Проблемы сохранения биологического разнообразия и использования биологических ресурсов: материалы III Международной научно-практической конференции, посвященной 110-летию со дня рождения академика Н. В. Смольского. В 2 ч. Ч.2. Минск, 2015. С.181-185
3. Макаренко А. И. "Размерные характеристики чужеродных и аборигенных видов амфипод в Беларуси" / Весці Нацыянальнай Акадэмii Навук Беларусі. Серыя біялагічных навук. № 1, 2015. С.100-105
4. Мордухай-Болтовской Ф. Д., Гезе И. И., Василенко С. В. "Отряд амфиподы, или разноногие, - Amphipoda" / Определитель фауны Черного и Азовского морей. т.2. Свободноживущие беспозвоночные. Ракообразные. Киев, 1969. С.440-524
5. Rewicz T., Grabowski M., MacNeil C., Bącela-Spychalska K. "The profile of a ‘perfect’ invader – the case of killer shrimp, Dikerogammarus villosus" / Aquatic Invasions (2014) Volume 9, Issue 3: 267–288
6. Lipinskaya T., Makarenko A., Semenchenko V., Vezhnovets V. "10-year monitoring of alien amphipods in Belarus: state of the art" / Biodiversity Journal, 2017, 8 (2): 649–651
7. Семенченко В. П., Вежновец В. В., Липинская Т. П. "Чужеродные виды Понто-каспийских амфипод (Crustacea, Amphipoda) в бассейне реки Днепр (Беларусь)" / Российский Журнал Биологических Инвазий № 3. 2013. С.88-97